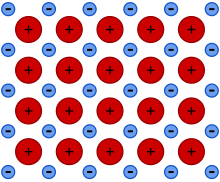
Enlace metálico
Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas.
Suelen ser sólidos a temperatura ambiente, excepto el mercurio, que tienen un punto de fusión muy bajo.
Es un enlace fuerte, primario, que se forma entre elementos de la misma especie.
Estos electrones libres son los responsables de que los metales presenten una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica.
Esta es la razón por la cual se puede explicar un deslizamiento de capas, dando por resultado su característica maleabilidad y ductilidad.
Con el advenimiento de la mecánica cuántica, esta imagen recibió una interpretación más formal en forma del modelo de electrón libre y su extensión posterior, el modelo del electrón casi libre.
El modelo de electrones casi libres fue adoptado con entusiasmo por algunos investigadores en este campo, en particular Hume-Rothery, en un intento de explicar por qué se formaban ciertas aleaciones intermetálicas con determinadas composiciones y otras no.
Así, la transición de los electrones no apareados localizados a los itinerantes que participan en el enlace metálico se hizo más comprensible.
El enlace metálico es mayoritariamente apolar, porque incluso en las aleaciones hay poca diferencia entre las electronegatividades de los átomos que participan en la interacción de enlace (y, en los metales elementales puros, ninguna en absoluto).
Los vapores metálicos, por el contrario, suelen ser atómicos (Hg) o a veces contienen moléculas, como Na2, unidas por un enlace covalente más convencional.
[aclaración requerida] La deslocalización es más pronunciada para los electrones s- y p. La deslocalización en el cesio es tan fuerte que los electrones están virtualmente liberados de los átomos de cesio para formar un gas limitado sólo por la superficie del metal.
Son elementos deficientes en electrones y el reparto comunal no cambia esta situación.
Por tanto, se cumplen ambos requisitos para la conductividad: fuerte deslocalización y bandas de energía parcialmente llenas.
Por tanto, estos electrones pueden cambiar fácilmente de un estado energético a otro ligeramente distinto.
En consecuencia, habrá más electrones moviéndose en una dirección que en otra y se producirá una corriente neta.
En presencia de impurezas disueltas, las escisiones que normalmente se forman con facilidad pueden bloquearse y el material endurecerse.
El oro, por ejemplo, es muy blando en estado puro (24-karat), por eso se prefieren las aleaciones en joyería.
Sin embargo, una sustancia como el diamante, que conduce bastante bien el calor, no es un conductor eléctrico.
Dado que los electrones son móviles, se pueden trasladar desde el electrodo negativo al positivo cuando el metal se somete al efecto de una diferencia de potencial eléctrico.
Los electrones móviles también pueden conducir el calor transportando la energía cinética de una parte a otra del cristal.
La corrección lleva el nombre de Victor Goldschmidt, quien obtuvo los valores numéricos citados anteriormente.