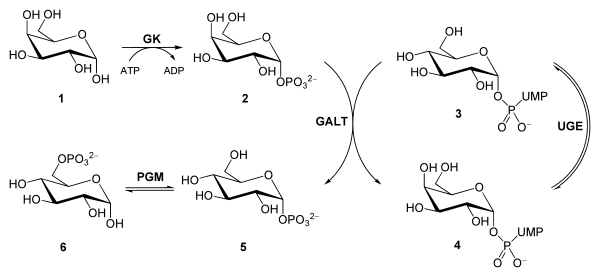
Galactoquinasa
La galactocinasa (EC 2.7.1.6) es una enzima fosfotransferasa que cataliza la fosforilación de la D-galactosa a D-galactosa-1-fosfato utilizando ATP como donante del grupo fosfato.
[4] La galactocinasa que fue aislada por primera vez del hígado de mamíferos, ha sido estudiada extensivamente en las levaduras,[5][6] arqueas,[7] plantas[8][9] y humanos.
El anillo adenina del ATP se une en un agujero hidrofóbico localizado en la interfaz entre los dos dominios.
El dominio N-terminal está compuesto por 5 filamentos formados de láminas beta y 5 hélices alfa.
El dominio C-terminal está caracterizado por dos capas de láminas beta antiparalelas y 6 hélices alfa.
Los miembros pertenecientes a la superfamilia GHMP tienen una gran similitud en su estructura tridimensional aunque solamente comparten entre un 10% y un 20% de su secuencia.