Reconfiguración de Favorskii
Esta transposición se lleva a cabo en presencia de una base, a veces hidróxido, para producir un ácido carboxílico, pero la mayor parte del tiempo, o bien un alcóxido o una amina para dar un éster o una amida respectivamente.
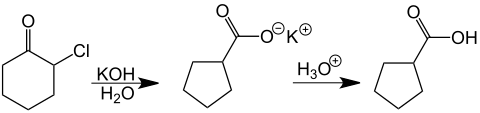
[1][2][3][4][5][6][7] En sus investigaciones sobre la química de las cetonas α-halogenadas Favorski observó que, tratando algunas dihalocetonas alifáticas del tipo RCH2CX2COCH2 R' con hidróxido de potasio diluido se formaban ácidos carboxílicos α,β-insaturados (véase más adelante).
Este enolato se cicla a una ciclopropanona como intermedio, que es atacado por el hidróxido nucleófilo.
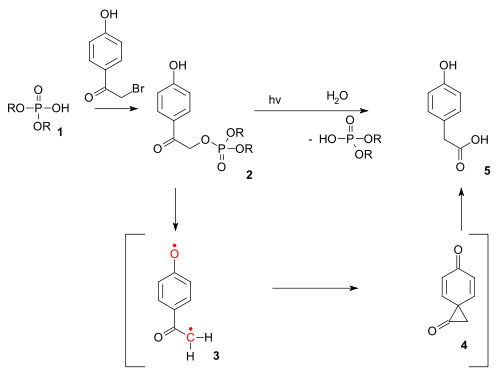
Se ha utilizado en el desbloqueo fotoquímica de ciertos fosfatos (por ejemplo los ATP) protegido por los llamados grupos p-hydroxyphenacyl.
[13] El producto de desprotección a través de un triplete birradical (3) y un diona espiro intermedio (4), aunque este último hasta ahora ha eludido la detección.