Sólidos moleculares
[3][4][5][8] Los sólidos moleculares son malos conductores eléctricos,[4][5] aunque algunos, como el TTF-TCNQ, son semiconductores (ρ = 5 x 102 Ω-1 cm-1)[5] y, aun así, su conductividad es sustancialmente inferior a la del cobre (ρ = 6 x 105 Ω-1 cm-1).
[1][2][3][4][5][6][7] Las interacciones intermoleculares entre los constituyentes dictan cómo se estructura la red cristalina del material.
[19] El argón es un gas noble que tiene un octeto completo, no tiene carga y es apolar.
[3][4][7][8] Estas características hacen que sea desfavorable para el argón participar en enlaces metálicos, covalentes e iónicos, así como en la mayoría de las interacciones intermoleculares.
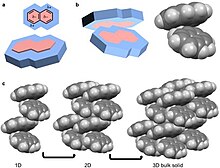
El octafluoronaftaleno sigue este camino de organización para construir materiales a granel, excepto que el δ- y el δ+ están en el exterior y el interior del sistema de anillos, respectivamente.
[5] Un enlace de hidrógeno es un dipolo específico en el que un átomo de hidrógeno tiene una carga positiva parcial (δ+) debido a un átomo electronegativo vecino o a un grupo funcional.
Esta coordinación da lugar a una organización en forma de cadena que se apila en 2D y luego en 3D.
[5] Esta carga negativa parcial provoca una fuerte interacción con la molécula tiol del TTF.
La fuerte interacción conduce a una alineación favorable de estos grupos funcionales adyacentes entre sí en estado sólido,[5][32] mientras que las interacciones π-π hacen que el TTF y el TCNQ se apilen en columnas separadas.
[38] Algunas formas de azufre y selenio están compuestas por unidades S8 (o Se8) y son sólidos moleculares en condiciones ambientales, pero se convierten en alótropos covalentes que tienen cadenas atómicas que se extienden por todo el cristal.
Los alótropos del fósforo son útiles para seguir demostrando esta relación estructura-propiedades.
[8][11] Una vez alcanzado el límite elástico, los sólidos dúctiles experimentan un periodo de deformación plástica y, finalmente, se fracturan.
[8][11] Los sólidos frágiles se fracturan inmediatamente después de superar el límite elástico.
Esto permite la dislocación entre las capas del cristal de forma muy parecida a los metales.
[11][30] Esta flexibilidad es anisotrópica; para doblar el HCB a 180° hay que tensionar la cara [001] del cristal.
[30] Otro ejemplo de sólido molecular flexible es el ácido 2-(metiltio)nicotínico (MTN).
Algunos sólidos moleculares presentan conductividad eléctrica, como TTF-TCNQ con ρ = 5 x 102 Ω-1 cm-1, pero en estos casos el solapamiento orbital es evidente en la estructura cristalina.
Los fullerenos, que son aislantes, se vuelven conductores o incluso superconductores al doparlos.