Topoisomerasas tipo I
[1][2] Este dominio supone un pliegue beta (2) -alfa-beta-alfa-beta (2), con un cruce cruzado zurdo entre las cadenas beta2 y beta3.
[4] Las topoisomerasas de ADN se dividen en dos clases: las enzimas tipo I (EC ; topoisomerasas I, III y V) rompen el ADN de cadena sencilla y las enzimas tipo II (EC; las topoisomerasas II, IV y VI) rompen el ADN de cadena doble.
[5] Las topoisomerasas de tipo IA, que históricamente se dice que se encuentran en procariotas, crean una sola ruptura en el ADN y pasan una segunda cadena o dúplex a través de la ruptura.
Ambos forman un intermedio de fosfotirosina 5 'y requieren un ion metálico divalente para realizar su trabajo.
La girasa inversa es particularmente interesante porque se une un dominio ATPasa, que se asemeja al dominio similar a la helicasa del factor de transcripción Rho (la estructura de la girasa inversa fue resuelta por Rodríguez y Stock, EMBO J 2002).
Se ha identificado que Topo III está asociado con la helicasa BLM (para el síndrome de Bloom) durante la recombinación.
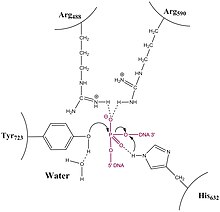
La tirosina catalítica escinde el esqueleto del ADN, creando un intermediario transitorio de fosfotirosina 5'.
Las estructuras cristalinas, la bioquímica y los experimentos con moléculas individuales han contribuido a un mecanismo general.
La enzima primero se envuelve alrededor del ADN y crea un único intermedio de fosfotirosina 3'.
La estructura de topo IB unida al ADN se ha resuelto (pdb id = 1A36).
Por el contrario, los experimentos con una sola molécula sugieren que la religión es un proceso aleatorio y tiene alguna probabilidad de ocurrir cada vez que el extremo giratorio 5'-OH se acerca al sitio de unión del extremo 3 'ligado a la enzima.
Se identificó un tercer tipo de topoisomerasa I, topo V, en el arqueón Methanopyrus kandleri.
Como tal, no es necesaria una fuente de energía externa para llevar a cabo esta reacción.