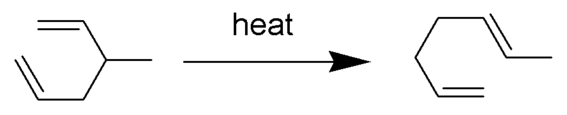
Transposición de Cope
A veces es útil pensar que pasa por un estado de transición energética y estructuralmente equivalente a un diradical, aunque debe enfatizarse que el diradical no suele ser un verdadero intermediario (mínimo de energía potencial).
Sin embargo, los sistemas conformacionalmente restringidos como los cis-1,2-divinilciclopropanos pueden sufrir la transposición en la conformación del bote.
Sin embargo, la reacción concertada a menudo puede ser asíncrona y los sistemas perturbados electrónicamente pueden tener un carácter diradical considerable en el estado de transición.
En el caso del hexa-1,5-dieno, la transposición es degenerada (el producto es idéntico al material de partida), por lo que K = 1 por necesidad.
En la transposición oxi-Cope, se agrega un grupo hidroxilo en C3 formando un enal o enone después del tautomerismo de Keto-enol del enol intermedio:[7][8] En su forma original, la reacción necesita temperaturas muy altas para proceder a una velocidad razonable.
En consecuencia, la reacción oxi-Cope acelerada por aniones puede proceder con alta eficiencia incluso en sistemas que no permiten una superposición orbital eficiente, como se ve en este ejemplo de la síntesis de periplanona B de Schreiber y Santini:[10]
Otro reordenamiento sigmatrópico ampliamente estudiado [3, 3] es la transposición de Claisen.