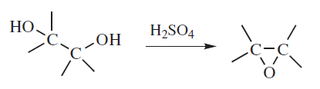Reacciones de alcoholes
[2] Los alcoholes pueden formar ésteres con ácidos inorgánicos (como el ácido sulfúrico, ácido nítrico o ácido fosfórico) o sus respectivos cloruros de acilo (Cloruro de fosforilo, cloruro de sulfurilo o fosgeno) Biológicamente, las quinasas (EC 2.7.1.-) son enzimas que transfieren grupos fosfato a grupos alcohol: Estas reacciones puede ser utilizadas para preparar halogenuros de alquilo primarios, secundarios y terciarios, pero los alcoholes neopentílicos muchas veces pueden transponer.
Para realizar este procedimiento se utiliza un ácido mineral para extraer el grupo hidroxilo (OH) desde el alcohol, generando una carga positiva en el carbono del cual fue extraído el Hidroxilo el cual tiene una interacción eléctrica con los electrones más cercanos (por defecto, electrones de un hidrógeno en el caso de no tener otro sustituyente) que forman un doble enlace en su lugar.
Se pueden mejorar los rendimientos en el caso de diarilcarbinoles (ArAr'CHOH) con ácido tosílico en estado sólido.
[11] Otros deshidratantes utilizados puede ser el Nafion con siliéteres,[12] y ácidos de Lewis (p. ejem.
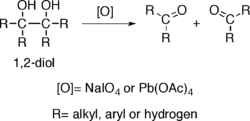
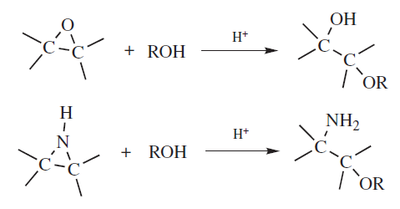
Los dioles vecinales pueden formar epóxidos: Nombre de acuerdo al sistema de March: Hidro,alcoxi-desdiazo-bisustitución Los alcoholes reaccionan con diazocompuestos para formar éteres, pero el diazometano y las diazocetonas reaccionan con mayor facilidad, produciendo así metiléteres o α-cetoéteres respectivamente[14] Con diazometano el método es costoso y requiere precauciones, pero las condiciones son moderadas y tiene altos rendimientos.
[15] El diazometano por lo general es utilizado para metilar alcoholes que pueden presentar reacciones indeseadas.
Los alcoholes ordinarios reaccionan en presencia de catalizadores tales como HBF4 (HF/BrF3)[16] o sílica gel.
También se han reportado catalizadores de [Rh(CO)2Cl]2,[20] TiCl3(OTf)[21] Fe(ClO4)3,[22] Cu(BF4)2.n H2O,[23] o BiCl3.
Al formarse el carbocatión, el alcohol se adiciona por el mecanismo de SN.
En la primera, el compuesto carbonílico reacciona con una cantidad equivalente de alcohol, en un equilibrio ácido-base por un mecanismo de adición-eliminación para formar un hemiacetal (o hemicetal, según sea aldehído o cetona).
El hemiacetal se protona posteriormente para formar el acetal otra vez por un mecanismo adición-eliminación.
Se pueden preparar carbamatos empleando alcoholes y un isociatato de alquilo.